【例题4-11】配制1000mLCNaOH=0.5mol/L的NaOH标准溶液,如何标定?
解:先配制NaOH的饱和溶液。称取100gNaOH,溶于100mL水中,摇匀,注入聚乙烯瓶中,密闭放置至溶液清亮。用塑料管虹吸26mL清液,注入1000mL无CO2的水中,摇匀。
标定:称取已在105-110℃干燥至恒重(3-4h的邻苯二甲酸氢钾2.5-3.5g(称准至0.0001g))4份,设m1=2.8619、m2=3.0368、m3=3.3282、m4=3.056g,分别溶解在80mL无CO2的水中,加2滴酚酞指示剂,用配好的NaOH溶液滴定至微红色为终点(溶液温度应不低于50℃)。设消耗的体积分别为V1=27.88、V2=29.58、V3=32.45、V4=29.80mL,同时作空白试验,V0=0。
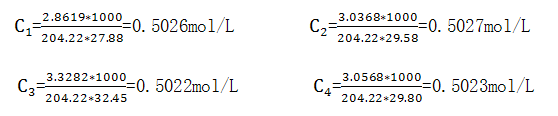
平均值=0.5024mol/L
以上举例说明用基准标定的全过程,凡用基准物标定时,都要按程序进行。
【例题4-12】用市售36%(m/m%)的浓HCl,配制CHCl=1.0mol/L盐酸标准溶液1000mL,如何配制及标定?
解:已知x=36%,ρ=1.18g/mL, MHCl=36.4g/mol, M1/2Na2CO3=52.99g/mol, CHCl=1.0mol/L
代入式4-8 得
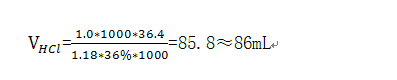
加水量1000-86=914mL
配制:量取86mL盐酸(ρ20=1.18g/mL),加入914mL水中,混合均匀。
标定:精确称量经180℃烘干2h,并于干燥器冷却的无水Na2CO3(0.1-0.15g)4份,分别放入250mL锥形瓶中,各加入100mL无CO2蒸馏水,加入2-4滴甲基橙指示剂。用配制好的1.0mol/L得盐酸滴定至出现淡桔红色为止。记录用量。同时做空白试验。
将各滴定结果代入4-10式,计算出盐酸标准溶液的准确浓度。
【例题4-13】配制CNa2S2O3=0.1mol/L的标准溶液100mL,如何配制和标定?
解:已知CNa2S2O3=0.1mol/L,V=1000mL,MNa2S2O3=248.18g/mol
代入式4-7 mNa2S2O3·5H2O=0.124*(1000/1000)*8.18=24.8g
配制:称取25gNa2S2O3·5H2O,溶于1000mL煮沸并冷却后的纯水中,此溶液浓度约为0.1mol/L。加入0.4g氧化钠或0.2g无水碳酸钠,贮于棕色瓶内,放置10天后进行标定。
标定:取碘酸钾(KIO3),在105℃下烘干1h,置于干燥器中冷却30min。准确称取4份,各约0.15g。分别放入250mL碘量瓶中。每瓶中各加入100mL纯水,使KIO3溶解,再各加3g碘化钾及10mL冰乙酸,在暗处放置5min。用待标定的Na2S2O3溶液滴定,直至溶液呈淡黄色时,加入1mL0.5%淀粉溶液,继续滴定至恰使蓝色褪去为止,记录用量。M1/2KIO3=35.67g/mol,将测定原始数据代入式(4-10)计算出硫代硫酸钠标准溶液的浓度。