酸碱指示剂是一种具有复杂结构的有机弱酸(用符号HIn表示)或有机弱碱(用符号InOH表示),也有两性的。它们具有一个共同的特点是,当溶液中H+浓度发生变化时,能发生颜色的变化。这是由于指示剂本身在不同的pH值条件下,可以有几种不同的结构,而不同的结构则显示出不同的颜色,因此当溶液的pH值发生变化时,就引起了颜色的变化。例如酚酞,它是一种非常弱的有机酸,若以HIn表示其分子,在溶液中存在着以下的电离平衡:

酚酞在电离的同时发生结构的变化,即分子和离子的结构不同,因而电离生成的离子与未电离的分子具有不同的颜色,分子HIn是无色的,而离子In-是红色的。如果在溶液中加入酸或碱,就会影响分子与离子之间的电离平衡,在酸性溶液中,由于大量H+的存在,平衡向左移动,酚酞主要以分子形式存在而呈无色;在碱性溶液中,由于H+浓度降低,上述平衡向右移动,酚酞主要以离子的形式存在而呈红色。
又如甲基橙,它是一种有机弱碱,用InOH表示其分子,其分子是黄色的,离子是红色的。在水溶液中存在以下的电离平衡:
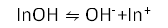
在酸性溶液中,平衡向右移动,溶液呈现出红色。在碱性溶液中,平衡向左移动,溶液呈现出黄色。
其他酸碱指示剂变色原理与酚酞及甲基橙类似。因此可以这样认为,指示剂分子和离子结构不同是颜色变化的内因,而溶液pH值的改变则是颜色变化的外因。实际上不是溶液的pH值稍有改变就能观察到指示剂颜色的变化,必须是溶液PH值改变到一定的范围,指示剂颜色的变化才能被观察到,这一范围,就是指示剂的变色范围。