氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。根据使用的氧化剂和还原剂不同,可分为高锰酸钾法、重铬酸钾法、碘量法等。氧化还原滴定法广泛地用于水质检验中,例如水中溶解氧(DO)、高锰酸钾指数、化学需氧量(COD)、生物化学需氧量(BOD520)等。
氧化还原反应是基于电子转移的反应,反应机理比较复杂,常伴随着副反应,且速度较慢,或者在同一反应中由于条件不同,可能生成不同的产物。例如,KMnO4在强酸性溶液中的还原产物Mn2+,在碱性溶液中还原产物为MnO2.因此,许多氧化还原反应不符合滴定分析的基本要求,必须创造适宜的条件,如控制温度、pH值等,才能进行氧化还原滴定分析。
氧化还原反应和电极电位
氧化还原反应是指物质之间有电子移动的反应。获得电子的物质叫氧化剂,失去电子的物质叫还原剂;物质获得电子时被还原,失去电子时被氧化。因此,氧化和还原反应总是同时发生的。在一个体系中,发生氧化反应,必然同时发生还原反应。例如:
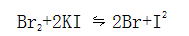
在反应中,Br2获得电子作氧化剂,I-失去作还原剂,Br2被还原,而I-被氧化。
对一些共价键化合物来说,可以根据共价键电子对偏移情况来确定氧化和还原。电子对偏移的一方(可以看成是获得电子)是氧化剂,电子对远离的一方(可以看成是失去电子)是还原剂。例如,氮气和氢气反应生成氨:
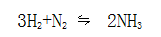
在氨分子中,共用电子对偏向N原子,所以N2是氧化剂,H2是还原剂。
由此可看到,有电子得失或共用电子对偏移的化学反应,称为氧化还原反应。这是氧化还原的本质。物质失去电子(化合价升高)的过程称为氧化;物质得到电子(化合价降低)的过程称为还原。
氧化和还原是同时发生的,在一个反应里,有得电力的,就必有失电子的,即有一物质被氧化,同时必有另一物质被还原,而且得失电子的总数必相等。判断一个反应是否属于氧化还原反应,只要看物质在反应前后化合价是否改变,即是否有电子得失或共用电子对偏移即可。