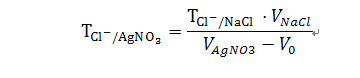【例题4-14】配制CEDTA-2Na=0.01mol/L的标准溶液1000mL,如何配制和标定?
解:已知CEDTA-2Na=0.01mol/L,V=1000mL,MEDTA-2Na=372.24g/mol,MZn=65.37g/mol
代入式4-7 mEDTA-2Na=0.01*372.24*(1000/1000)=3.72g
配制:称取3.75-3.8g(因试剂纯度问题可适量多称一些)EDTA-2Na,溶于纯水中,并稀释至1000mL,混匀后待标定。
标定:准确称0.6-0.8g的锌粒,溶于1+1盐酸中,置水浴上热至完全溶解。移入容量瓶中,定容至1000mL,其浓度按下式求出:
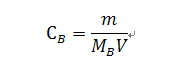
吸取25.00mL锌标准溶液于150mL锥形瓶中(取4份作平行实验),加入25mL纯水,加氨水调整pH至中性,再加入2mL缓冲溶液及5滴铬黑T指示剂,用EDTA-2Na溶液滴定至溶液由紫红色变为蓝色,分别记录用量。按(4-10)式计算EDTA-2Na标准溶液的浓度。
【例题4-15】 配制TCl-/AgNO3=0.5mg/mL的AgNO3标准溶液1000mL应如何配制和标定。
解TCl-/AgNO3=0.5mg/mL,V=1000mL,MAgNO3=169.87g/mol,MCl-=35.45g/mol

配制:称取2.4gAgNO3,溶于纯水中并定容至1000mL。
标定:吸取25.00mL标准溶液,每毫升相当于0.5000gCl-4份,分别置于瓷蒸发皿中。加纯水25mL。
另取一瓷蒸发皿加50mL纯水作为空白各加入1mL铬酸钾溶液(指示剂),用配制好的AgNO3标准溶液滴定。同时用玻璃棒不停地搅拌,直至产生淡桔黄色为止。每毫升AgNO3相当于氯化物(Cl-)的毫克数可由下式计算。